期刊VIP學術指導 符合學術規范和道德
保障品質 保證專業,沒有后顧之憂
期刊VIP學術指導 符合學術規范和道德
保障品質 保證專業,沒有后顧之憂
1 材料和方法
1.1 材料
獲取膝骨關節炎患者膝關節置換術中廢棄的軟骨組織(經患者及家屬同意,通過醫院倫理審查)。COL2A1、MMP13、miR-9 及 PRTG 檢測試劑盒(蘇州昂飛生物科技有限公司);蛇床子素(徐州醫科大學藥學院天然藥物化學研究室)。
1.2 方法
1.2.1 軟骨細胞提取及培養
收集膝骨關節炎患者關節置換術后廢棄的無菌軟骨標本,置于無血清 DMEM 培養基,冰盒轉移至超凈臺,去除多余組織,剪切成 1~3mm 碎塊。用 0.25% 胰蛋白酶和 0.2%Ⅱ 型膠原酶在 37℃恒溫搖床中分別消化 30min 和 8h,過濾后收集濾液,1000r/min 離心 5min,棄上清,PBS 浸洗 2 遍,加入含 10% 血清 DMEM/F-12 培養液制成細胞懸液,移入培養瓶,在 37℃、5% CO?飽和濕度培養箱中培養。定期觀察細胞生長形態和貼壁情況,用第 3 代軟骨細胞進行實驗。
1.2.2 軟骨細胞鑒定
形態學觀察:通過倒置相差顯微鏡觀察原代培養軟骨細胞的形態學特征和生長增殖情況并照相。
甲苯胺藍染色法:取第 3 代軟骨細胞進行細胞爬片,貼壁后去除培養液,PBS 清洗 2 遍,4% 多聚甲醛固定 1h,1% 甲苯胺藍染色 30min,雙蒸水洗去多余染液,無水乙醇脫水,中性樹膠封片,倒置相差顯微鏡下觀察并照相。
1.2.3 細胞分組處理
取第 3 代軟骨細胞,分為空白對照組和不同濃度蛇床子素處理組(0、10、50、100、150μmol/L),用含 10% 血清的 DMEM/F-12 培養液在 37℃、5% CO?飽和濕度培養箱中培養。
1.2.4 CCK-8 法檢測細胞增殖
96 孔培養板中每孔接種濃度為 5×10?個 /mL 的軟骨細胞懸液,37℃孵育 4~6h,各組設 6 個復孔。細胞貼壁后加入不同濃度蛇床子素,孵育 24h,每孔加 10μL CCK-8 試劑,酶標儀 450nm 波長處檢測光密度(OD)值估計細胞活力。
1.2.5 流式細胞儀檢測細胞凋亡情況
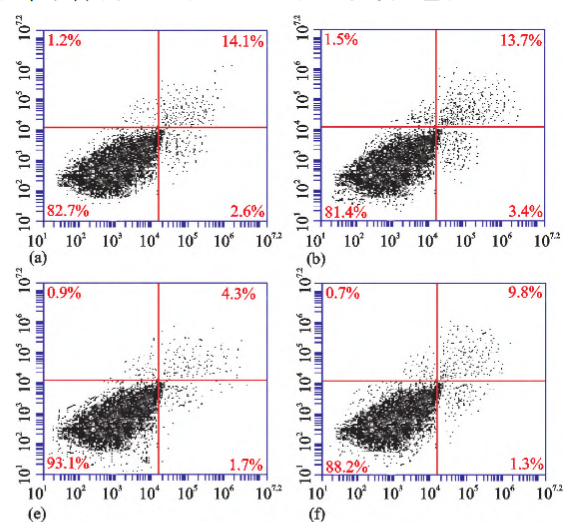
收集處理后的第 3 代軟骨細胞,用碘化丙啶(PI)和異硫氰酸熒光素偶聯的 AnnexinV 染色,流式細胞儀檢測凋亡并繪制散點圖統計凋亡率。
1.2.6 qRT-PCR 檢測
對數生長期細胞采用 Trizol 法提取總 RNA,用 PrimeScript RT reagent Kit 逆轉錄為 cDNA。以 U6 作為內參,用 ABI7500 實時定量 PCR 儀進行實驗,Opticon Monitor3 軟件分析結果。引物序列如下:
目的基因引物序列
U65'-GCTTCGGCAGCACATATACT-3';5'-CGCTTCACGAATTTGCGTGT-3'
miR-95'-GGAGTCCGTGTGTCTGTGTG-3';5'-GCTTTATGACGGCTCTGTGG-3'
COL2A15'-GACGCCACGCTCAGTC-3';5'-TCTCCGCTCTTCCACTCTG-3'
MMP135'-TGGGCCTTCTGGTCTTC-3';5'-GTTGTAGCCTTTGGAGATG-3'
PRTG5'-CGAAGCAAAGCCAGGAAGTC-3';5'-GCTTGTTGTGAATCCCTGAGCG-3'
Caspase-35'-AAGCGAATCAATGGACTCTGG-3'
1.2.7 Western Blot 法檢測
對數生長期軟骨細胞加蛋白裂解液提取總蛋白,Bradford 法定量。總蛋白(50μg)經 12% SDS-PAGE 電泳后轉移至 PVDF 膜,與抗 COL2A1、MMP
13、miR-9、PRTG、Caspase-3 及 β-actin 單克隆抗體 4℃孵育過夜。PBST 洗膜 3 次(每次 5min),加入辣根過氧化物酶標記的羊抗兔二抗室溫孵育 2h,洗膜后用魯米諾試劑和過氧化氫溶液(1∶1)顯色,掃描拍照分析,以目標條帶與內參照條帶灰度值之比作為蛋白質相對表達水平。
1.3 統計學方法
采用 SPSS20.0 統計軟件,計量資料以 x±s 表示,組間比較用單因素方差分析,方差不齊時采用布朗 - 福賽斯和韋爾奇方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 軟骨細胞形態學觀察
軟骨細胞多呈多邊形,甲苯胺藍染色后細胞核為藍色。0、10、50、100μmol/L 蛇床子素處理后的軟骨細胞形態無明顯改變。CCK-8 實驗顯示,蛇床子素濃度超過 100μmol/L 時細胞活力顯著下降,≤100μmol/L 時對軟骨細胞無毒,其中 100μmol/L 蛇床子素的保護作用最強。
2.2 軟骨細胞凋亡情況
空白對照組軟骨細胞凋亡率為 14.60%±1.21%,0、10、50μmol/L 蛇床子素處理組凋亡率(13.25%±1.32%)無明顯變化;100μmol/L 蛇床子素處理組凋亡率降至 5.67%±1.43%,與對照組及低濃度組比較差異有統計學意義(P<0.05);150μmol/L 組凋亡率為 10.31%±1.16%,與 100μmol/L 組比較差異有統計學意義(P<0.05)。表明 100μmol/L 蛇床子素抑制軟骨細胞凋亡作用最強。
2.3 qRT-PCR 檢測結果
空白對照組及 0、10、50、150μmol/L 蛇床子素處理組中,miR-9、COL2A1、MMP13、PRTG 及 Caspase-3 的 mRNA 表達無明顯變化;100μmol/L 蛇床子素處理組中,miR-9 和 COL2A1 表達上調,MMP13、PRTG 及 Caspase-3 表達下調,與其他組比較差異有統計學意義(P<0.05)。提示蛇床子素可能通過上調 miR-9 抑制 PRTG 表達,調節 p53/Caspase-3 通路,抑制軟骨細胞凋亡和基質降解。
2.4 Western Blot 法檢測結果
0、10、50、150μmol/L 蛇床子素處理組中,miR-9、COL2A1、MMP13、PRTG 及 Caspase-3 的蛋白表達無明顯變化;100μmol/L 蛇床子素處理組中,miR-9 和 COL2A1 蛋白表達上調,MMP13、PRTG 及 Caspase-3 蛋白表達下調,與對照組比較差異有統計學意義(P<0.05),進一步證實 100μmol/L 蛇床子素可抑制軟骨細胞凋亡和基質降解。
3 討論
膝骨關節炎(KOA)以膝關節疼痛、畸形及功能障礙為特征,蛇床子素(OST)具有抗氧化、止痛等作用,可能通過調控軟骨細胞增殖與凋亡緩解軟骨退變。本研究顯示,100μmol/L 蛇床子素可顯著減少膝骨關節炎軟骨細胞凋亡,上調 miR-9 和 COL2A1 表達,下調 MMP13、PRTG 及 Caspase-3 表達(P<0.05)。
機制上,miR-9 在 KOA 患者中表達降低,可通過靶向 PRTG 基因調節軟骨細胞活性;PRTG 過表達會激活 p53/Caspase-3 通路促進軟骨細胞凋亡。蛇床子素可能通過上調 miR-9 抑制 PRTG 和 Caspase-3,阻斷軟骨細胞凋亡及基質降解,從而保護關節軟骨,緩解骨關節炎進展。
本研究存在局限性,如軟骨細胞來源單一,后續需通過不同供體樣本及基因敲除動物模型進一步驗證結論。
參考文獻
[1] HALL M,VAN DER ESCH M,HINMAN R S,etal. Howdoeshiposteoarthritisdifferfromkneeosteoarthritis? [J].OsteoarthritisCartilage,2022,30(1):32-41.
[2] LIN Z,MIAO J,ZHANG T,etal.d-Mannosesuppresses osteoarthritisdevelopmentinvivoand delaysIL-1β-induceddegenerationinvitrobyenhancingautophagyactivatedviatheAMPKpathway[J].BiomedPharmacother, 2021,135:111199.
[3] CHERN C M,ZHOU H,WANG Y H,etal.Osthole amelioratescartilage degradation by downregulation of NF-κBand HIF-2αpathwaysinanosteoarthritismurine model[J].EurJPharmacol,2020,867:172799.
[4] XIA S,TIAN H,FAN L,etal.PeripheralbloodmiR-1815pservesasamarkerforscreeningpatientswithosteoarthritisbytargeting TNF-α[J].ClinLab,2017,63(11): 1819-1825.
[5] LI S H,GAO P,WANG L T,etal.Ostholestimulated neural stem cells differentiation into neurons in an Alzheimer's disease cell model via upregulation of microRNA-9andrescuedthefunctionalimpairmentof hippocampalneuronsin APP/PS1transgenic mice[J].FrontNeurosci,2017,11:340.
[6] CHEN H,YANG J,TAN Z.UpregulationofmicroRNA9-5pinhibitsapoptosisofchondrocytesthroughdownregulatingTNCin mice withosteoarthritisfollowingtibial plateaufracture[J].JCellPhysiol,2019,234(12):23326-23336.
[7] ZHANG G,ZHANG H,YOU W,etal.Therapeuticeffect ofresveratrolinthetreatmentofosteoarthritisviathe MALAT1/miR-9/NF-κBsignalingpathway[J].ExpTher Med,2020,19(3):2343-2352.
[8] 乙軍,周業庭,潘武,等。獨活揮發油關節腔注射對實驗性兔膝骨性關節炎的影響 [J]. 臨床和實驗醫學雜志,2014,2 (20):1670-1672.
[9] LI F,YAO J,HAO Q,etal.miRNA-103promoteschondrocyte apoptosis by down-regulation of Sphingosine kinase-1andamelioratesPI3K/AKTpathwayinosteoarthritis[J].BiosciRep,2019,39(10):BSR20191255.
[10] LI J,HUANG J,DAI L,etal.miR-146a,anIL-1βresponsivemiRNA,inducesvascularendothelialgrowthfactor andchondrocyteapoptosisbytargetingSmad4[J].ArthritisResTher,2012,14(2):R75.
[11] WANG M,GAO Q,CHEN Y,etal.PAK4,atargetof miR-9-5p,promotescellproliferationandinhibitsapoptosisincolorectalcancer[J].CellMolBiolLett,2019,24:58.
[12] WEI Y Q,JIAO X L,ZHANG S Y,etal.MiR-9-5pcould promoteangiogenesisandradiosensitivityincervicalcancerbytargetingSOCS5[J].EurRev MedPharmacolSci, 2019,23(17):7314-7326.
[13] 張彥秋,張永濤.miR-9 對骨性關節炎細胞凋亡的影響及與 protogenin 的靶向關系 [J]. 廣東醫學,2014,35 (21):3313-3316.
[14] HUANG Y,CHEN D,YAN Z,etal.LncRNA MEG3 protectschondrocytesfrom IL-1β-inducedinflammation viaregulating miR-9-5p/KLF4axis[J].FrontPhysiol, 2021,12:617654.
[15] ZHOU D,WEI Y,SHENG S,etal.MMP13-targeted siRNA-loaded micellesfor diagnosis and treatment of posttraumaticosteoarthritis[J].Bioact Mater,2024,37 (2):378-392.
[16] VINCENTI M P,BRINCKERHOFF C E.Earlyresponse genesinducedinchondrocytesstimulatedwiththeinflammatorycytokineinterleukin-1β[J].ArthritisRes,2001,3 (6):381-388.
如果您現在遇到期刊選擇、論文內容改善、論文投稿周期長、難錄用、多次退修、多次被拒等問題,可以告訴學術顧問,解答疑問同時給出解決方案 。